分享:Ti及鈦合金表面改性在生物醫用領域的研究進展
Ti及鈦合金作為人體硬組織的主要替代物之一,在生物醫用領域應用廣泛。為了更好地滿足Ti及鈦合金在人體中植入后的安全、舒適、耐久等需求,Ti及鈦合金表面改性處理成為了研究的熱點。本文基于Ti及鈦合金的基礎性能和存在的問題,從表面改性提高其力學性能、生物相容性、抑菌/抗菌性能等方面綜述了Ti及鈦合金表面改性在生物醫用領域的研究進展,并提出了面臨的挑戰以及發展方向的建議。
關鍵詞:
Ti及鈦合金具有優良的力學性能、耐腐蝕性能、良好的生物相容性等優點,已被廣泛應用于生物醫學領域[1~3]。相比于其他傳統人體硬組織替代物候選材料,如不銹鋼(易發生點腐蝕,釋放有毒的合金元素Ni等)、Co-Cr合金(易發生微動腐蝕,釋放有毒的合金元素Co、Cr等)、鎂合金(力學強度較低,更易被腐蝕)和Au、Ag、Pt、Ta等貴金屬(價格昂貴)而言,Ti及鈦合金有著更高的比強度、更小的毒性、更好的抗腐蝕能力以及更低的成本[4~8]。同時,相比于不銹鋼和Co-Cr合金,鈦合金還有著與骨骼更牢固的結合能力,兼具與人體骨骼更接近的Young's模量,有利于減少應力屏蔽等問題(骨和植入體之間Young's模量的不匹配)[9],顯示出更具優勢的應用前景。隨著對Ti及鈦合金的研究不斷深入開展,研究者對其生物毒性、生物相容性等領域進行了系統研究。結果顯示,通過對其表面進行改性處理可以提高鈦合金的生物相容性,并降低其生物毒性、提高其抗菌性能。因此,有必要對近些年的相關研究結果進行歸納總結,從而為Ti及鈦合金的生物應用提供一定的理論指導。
金屬Ti有2種晶體結構,882℃以下的為hcp-α結構,882℃以上的為bcc-β結構。生物醫用的純Ti主要是α結構。根據Ti的2種結構,鈦合金也相應地被分為3類:Ti原子以hcp排列的α固溶體合金、以bcc排列的β固溶體合金和同時具有2種排列方式的α + β合金。穩定α固溶體的合金元素主要包括Al、Ga、C、N、O等,其中Al是α固溶體合金的主要元素;穩定β固溶體的合金元素主要包括Nb、Mo、V、Mn、Fe、Ta等。相比于α和α + β合金,β合金往往有著更高的韌性,更接近人體骨骼的Young's模量,因此很適合作為人體植入體的材料,如Ti-15Mo (質量分數,%,下同)、Ti-13Nb-13Zr、Ti-12Mo-Zr-2Fe、Ti-16Nb-9.5Hf等[10~14]。α + β合金的典型代表是Ti-6Al-4V,是研究最為廣泛的生物醫用材料之一,但是其在人體中會釋放對細胞有害的Al3+和V5+,具有一定的生物毒性。在此基礎上,研究者開發了一系列不含有毒金屬元素的鈦合金,而且在疲勞強度、抗腐蝕強度等方面同樣優異,如Ti-15Zr-4Nb-4Ta-0.2Pd和Ti-15Zr-4Nb-4Ta-0.2Pd-(0.20~0.05)N。
無論是純Ti金屬,還是不同成分、結構的鈦合金,都面臨著以下問題:(1) 植入后的炎癥反應。即使是與人體骨骼Young's模量更加接近的Ti及鈦合金,它們仍具有生物惰性,不利于成骨反應,在植入后與周圍骨骼結合方式主要為機械結合,該結合方式會導致植入體與骨骼產生微動,微動帶來的摩擦會產生很多碎屑,碎屑的聚集最終會引發炎癥[15~18];(2) 植入后力學性能的下降。Ti和鈦合金植入體與體液的長時間接觸,尤其在微動摩擦后表面結構受到破壞后,容易受到體液中離子的腐蝕,導致合金的力學性能下降,如腐蝕開裂、氧化層變厚[19];(3) 合金的腐蝕效應導致生物毒性。合金中的合金元素也會因為腐蝕反應溶解、釋放到人體體液中,對人體產生毒害作用,如Al具有神經毒性,會引發神經問題和腦損傷,V及其化合物具有細胞毒性等[17,20~23];(4) 植入后的細菌感染。Ti及鈦合金植入體在植入時,由于本身缺乏抗菌性進而引發術中細菌感染,導致手術失敗[24~27]。
為了解決Ti及鈦合金表面硬度低、耐磨性差、耐腐蝕能力不足、生物相容性不足以及自身抗菌性差等問題,對Ti及鈦合金進行表面改性處理是一種非常有效的解決辦法。具體的表面改性處理方案包括以下幾點:(1) 通過改變成分、表面處理或者覆蓋表面涂層,提高其力學性能、硬度、耐磨性和耐腐蝕性,避免表面結構的破壞引發的后續問題;(2) 賦予Ti及鈦合金植入體生物活性,促進植入體周圍的人體組織細胞的黏附、增殖,提高植入體的生物相容性;(3) 使Ti及鈦合金植入體自身表面具有抑菌/抗菌性能。
成分設計為物理改性,代表性方法為合金熔煉。表面改性處理提高Ti及鈦合金植入體性能的方法主要分為物理改性和化學改性。物理改性方法包括物理氣相沉積、熱噴涂、高溫熱處理、激光處理、3D打印、輝光放電等;化學改性方法包括酸堿反應、水熱反應、陽極氧化、化學氣相沉積等。一種方法或者多種方法的結合使用可以在改善Ti及鈦合金力學及耐磨損、耐腐蝕等性能的同時改善其生物相容性、抑菌性能等,同一種方法在改善Ti及鈦合金幾種性能上的適用性也不盡相同。
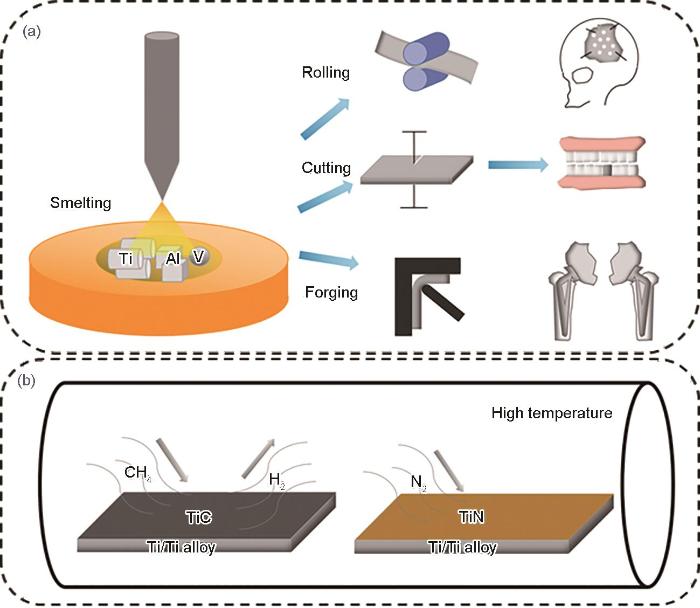
電弧熔融處理(arc treatment)是制備鈦合金、調節合金成分(尤其是合金表面成分)的有效方法之一。Ti及鈦合金成分的調控可以顯著提高其耐腐蝕性能、抗磨損性能、硬度等,而合金整體成分的改變也會有效提高其彈性等。將合金元素按所需比例進行配料并放置在熔煉爐中,在Ar氣氛下將幾種元素均勻地熔煉以形成合金,并通過熱軋、切割、熱處理等工藝加工為需要的形狀,如圖1a所示。不同組成成分的合金性能差異較大,相同組成元素但是比例不同的合金性能也不盡相同。由β相穩定元素Zr和Mo形成的Ti-15Zr-xMo合金具有較高的硬度、較低的Young's模量,與細胞接觸時具有可耐受的細胞毒性水平;其中,Ti-15Zr-7.5Mo合金由于ω相析出而具有最高的力學性能,而Ti-15Zr-15Mo合金為生物醫學應用提供了最佳的性能組合,具有良好力學性能的同時還促進了成骨細胞的黏附[28]。β型合金Ti-45Nb在低Young's模量(64.3 GPa)、高拉伸強度(527 MPa)和高硬度(233.4 MPa)之間取得了平衡,相比于純Ti,合金沒有額外的副作用,且具有更好的耐腐蝕性[29]。在Ti-27.5Nb合金中熔入Ag元素,降低了合金的硬度,提高了合金的韌性。當Ag含量為0.7% (質量分數)時,在不影響合金本身的細胞黏附和增殖行為的同時提供了優異的抗菌性能[30]。Zhou等[31]制備了Ti-Nb-Zr合金并研究了Zr含量對合金相變、顯微組織和力學性能的影響。Zr的添加可以使合金相穩定,Zr含量的增加,細化了合金的顯微組織,并提高了強度,而塑性顯著降低。其中,Ti-25Nb-2Zr合金具有最低的Young's模量,為62 GPa,其主要歸因于應力誘發馬氏體相的形成。在Ti-Bi合金中,Bi元素的加入提高了純Ti的可鑄造性,合金的拉伸強度、硬度和耐磨性隨Bi含量增加單調遞增。相比于純Ti,Ti-Bi合金分別在唾液、含有0.2%NaF和0.3%C3H6O3的溶液中顯示出了更好的耐腐蝕性能,同時合金顯示出非溶血性特征,在牙科領域中具有良好應用潛力[32]。對Ti-10Ta-10Nb合金和Ti-6Al-4V合金進行相同的氧化處理,2者的氧化膜均為金紅石型TiO2,但是Ti-10Ta-10Nb合金顯示出更致密、更薄的氧化層,在提高合金耐蝕性能的同時降低了細胞的毒性[33]。
圖1 電弧熔融制備鈦合金及其應用示意圖、鈦合金高溫氣體熱處理示意圖
Fig.1 Schematics of the preparation of titanium alloy by arc melting and its application (a) and high temperature gas heat treatment of titanium alloy (b)
電弧熔融處理不僅可以靈活地改變合金成分,精確地調控鈦合金成分、比例,設計具有不同功能的鈦合金,而且制備的鈦合金成分均勻、穩定性好,可以有效改善鈦合金的多種性能,適用于大部分鈦合金的制備。
高溫氣體熱處理(gas heat treatment),如高溫氮化、碳化可以改變Ti及鈦合金的表面組織結構,提高表面性能,如圖1b所示。Li等[36]對純Ti和Ti-6Al-4V合金進行了不同溫度的高溫氮化處理,在700℃下氮化的Ti的抗氣蝕性相比未經處理的試樣提高了2.65倍,原因在于氮擴散區具有高硬度、無裂紋和良好冶金結合的均勻結構,阻止了微裂紋向內部擴展并延緩了侵蝕;在1000℃下氮化的Ti則具有最低的抗氣蝕性,因為該溫度下熱處理破壞了Ti的微觀結構,導致抗氣蝕性降低。對于Ti-6Al-4V合金,與純Ti相反,1000℃下氮化的Ti-6Al-4V合金表現出最高的抗氣蝕性。在Ti-6Al-4V合金中,氮擴散區由硬質α-Ti晶粒和軟質β-Ti晶粒組成,軟質β-Ti晶粒的存在導致選擇性氣蝕,加速了侵蝕過程。但合金在1000℃下處理后,由于N的固溶誘導了β-Ti向α-Ti的轉變,促進了富氮α-Ti晶粒層的形成,抗氣蝕性相比原始合金增加了6.72倍。Li等[37]還通過對Ti-6Al-4V合金進行固體滲碳處理在樣品表面形成陶瓷涂層,改善了合金的抗氣蝕性。涂層結構包含TiC和少量氧化物。空蝕實驗結果表明,與未處理的樣品相比,處理后的樣品抗氣蝕性(平均侵蝕率的倒數)由3.44增加至6.68。TiC薄膜的存在也可以提高Ti及其合金的耐磨性,尤其在種植牙的表面和人體關節部分[38]。
高溫熱處理可以提高合金性能。Li等[39]研究了β型Ti-24Nb-2Zr合金高溫時效處理后的超彈性和變形行為,隨著時效時間的增加,合金中會形成ω相,適量的ω相能提高β相屈服強度,使更多β相在屈服前發生應力誘發α"馬氏體轉變,同時抑制α"相的長大和塑性變形,促進α"相卸載后回復成母相,進而提高了合金的超彈性回復能力。
相比于高溫熱處理,高溫氣體熱處理僅針對鈦合金表面進行改性處理,在改變表面性能的同時,還能保持鈦合金整體原有的性能,實現鈦合金多種性能的結合。
放電等離子燒結(spark plasma sintering)可以降低燒結材料(通常為金屬粉末)的燒結溫度,尤其是對于鈦合金組分中熔點差別較大的金屬元素,可以有效避免低熔點組分材料的揮發,并且能夠使粉末快速燒結致密,是一種有前景的粉末冶金燒結技術,如圖2a所示。Liu等[40]首先將熔點差別較大的2種金屬Ti、Mg通過球磨的方式機械合金化,再通過放電等離子燒結技術形成了不同比例的Ti-Mg合金,合金中含有納米晶相Mg和Ti的均勻混合物,具有適用于生物醫學的新型特性,Mg的加入降低了合金的Young's模量,并且Mg可以在環境溶液中溶解誘導Ca3(PO4)2的形成,提高合金生物活性;但是,合金的耐蝕性能隨Mg含量的增加而降低。Karre等[41]分別通過放電等離子燒結技術和常規燒結技術制備了Ti-Nb合金,放電等離子燒結所制備的合金的Young's模量(80 GPa)相比于常規燒結((90 ± 10) GPa)更低,硬度也相對更低,更適用于人體。
圖2 放電等離子燒結制備Ti-Mg合金和鈦合金激光表面改性示意圖
Fig.2 Schematics of the preparation of Ti-Mg alloy by spark plasma sintering (a) and laser surface modification of Ti alloy (b)
放電等離子燒結技術主要應用于成分熔點差別較大的特定合金制備,但是制備的合金無法再次進行熱處理、激光處理等高溫處理,后續功能化處理困難,適用范圍相對受限。
激光表面熔敷陶瓷層可以更好地控制陶瓷涂層的結構和厚度,產生致密無裂紋的陶瓷涂層。配合等離子噴涂等工藝可以獲得光滑、致密的表面涂層,提高植入體表面強度和耐蝕能力。通過物理氣相沉積也可以制備TiN涂層。
激光表面改性的優點在于可以對鈦合金進行局部選擇性處理,改變局部區域的組織,制備局部涂層,對局部區域改性的可控性高,在加工、應用中更加靈活。
電弧熔融處理是制備各種成分鈦合金的主要方法,可以制備大多數不同成分、比例的鈦合金,但合金各成分熔點不能相差過大,否則合金成分、比例將失調甚至合金成分缺失;等離子燒結主要用來制備合金成分熔點相差較大的特定合金,彌補了電弧熔融處理方法的不足。鈦合金成分是決定其性能的主要因素。高溫氣體熱處理可以在保持鈦合金整體性能的同時進一步表面功能化,使得合金具備原本沒有的特性;激光表面改性處理既可以通過合金相轉變的方式提高表面性能,又可以結合外源物質、改變合金表面成分以制備涂層的方式提高表面性能。相比于高溫氣體熱處理,激光表面改性具有局部選擇性,靈活性更高。鈦合金成分的調控結合表面改性處理可以最大程度地滿足對合金所需的性能要求,可以應用于人體骨骼、牙齒等多個部位,制備性能更加完善的鈦合金仍然是主要的研究方向。
表面處理提高Ti及鈦合金的表面粗糙度和添加表面生物活性物質是提高Ti及鈦合金植入體生物相容性的主要手段。表面粗糙度是指表面微小的兩波峰或者兩波谷的距離,距離越大表面越粗糙。Ti及鈦合金植入體表面粗糙度在早期成骨細胞黏附、增殖和整合中具有重要作用,合適的粗糙度(分為精細粗糙(1~3 µm)、粗糙(6~10 µm)和宏觀粗糙(10~30 µm))可以大大改善植入體的生物相容性,過度的粗糙度則會降低植入體力學性能[48]。添加表面生物活性物質(如沉積活性涂層)可以提高細胞活力,加快細胞在鈦合金植入體表面的黏附、增殖,加快骨整合。
圖3 噴砂、酸蝕及其組合,3D打印及激光表面紋理化示意圖
Fig.3 Schematics of sandblasting, acid etching, and their combination (a), 3D printing (b), and laser surface texturing (c)
噴砂、酸蝕及其組合使用是早期的表面處理方法,具有操作簡單、成本低等優點,多用于牙種植體的表面改性。
3D打印技術除了能提高鈦合金表面粗糙度以外,還可以直接制備合金或非合金的牙齒、骨骼、組織器官、假肢以及手術預演模型等,具有很大的應用前景。
激光在輔助表面改性的同時,也可以通過自身的高能量狀態直接在Ti及鈦合金表面產生坑洞,提高表面粗糙度,坑洞的尺寸、深度取決于激光光斑的尺寸、功率等因素,該方法稱為激光表面紋理化(laser surface texturing)。如圖3c所示,利用激光可以在植入體表面有規律地轟擊出一系列的坑洞,產生紋理[59]。激光表面紋理化后可以改變Ti及鈦合金植入體表面的粗糙度、濕潤性、摩擦系數等,尤其粗糙度的改變可以促進正常細胞的黏附和生長[60]。例如Cunha等[61]通過飛秒激光表面紋理化在Ti表面制備了納米柱和周期性表面結構,納米柱增強了Ti表面的親水性,周期性表面結構則減少了金黃色葡萄球菌在Ti表面的黏附。
激光表面紋理化由于其高度可控性,不僅可以在Ti及鈦合金表面產生紋理,還可以在合金表面的功能性涂層上制造紋理,應用更加廣泛。
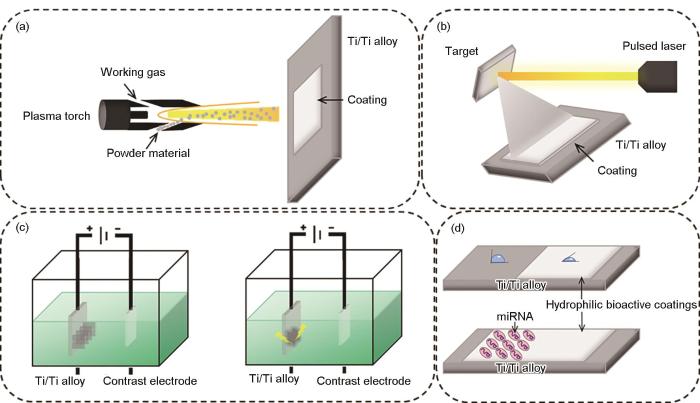
等離子噴涂(plasma spray)同樣是增加Ti及鈦合金植入體表面粗糙度的有效方法,其機理是利用直流電弧等離子槍將所需材料熔化并噴涂在Ti及鈦合金基體上,如圖4a所示。相比于噴砂,等離子噴涂可制造更小的納米尺度的表面粗糙結構,大大增加了比表面積,加快了細胞黏附和骨整合[62,63]。在Ti及鈦合金表面等離子噴涂人體骨骼的主要無機成分羥基磷灰石,在改善表面粗糙度的同時,還可以顯著增加植入體的生物活性,促使植入體與機體組織快速結合,釋放誘導成骨離子,加快術后受損組織的恢復。例如,羥基磷灰石涂層/Ti-6Al-4V合金復合材料具有與天然骨骼類似的力學性能,尤其是拉伸強度和韌性[64];Hameed等[65]通過不同參數下的軸向懸浮等離子噴涂和大氣等離子噴涂2種方式將羥基磷灰石噴涂在Ti-6Al-4V合金表面,其中軸向懸浮等離子噴涂產物中顯示出了最佳的生物活性(黏合強度提高了1.3倍),耐腐蝕性能提高了9.5倍;鈦合金表面的羥基磷灰石/TiO2復合涂層呈現出了納米多孔形貌,與天然骨骼表面形貌類似,極大地促進了植入體與骨骼、細胞組織的結合[66]。
圖4 等離子噴涂制備涂層、脈沖激光沉積制備涂層、陽極氧化/等離子體電解氧化/微弧氧化表面改性及基因治療示意圖
Fig.4 Schematics of coatings prepared by plasma spraying (a), coatings prepared by pulsed laser deposition (b), surface modification by anodizing/plasma electrolytic oxidation/micro-arc oxidation (c), and gene therapy (d)
等離子噴涂技術在噴涂生物活性涂層的同時使涂層具有納米尺度的表面粗糙度,2者的結合可以顯著提高Ti及鈦合金生物相容性,而且該方法制備的涂層結構致密、黏結強度高、不易氧化,是非常有應用前景的方法。
脈沖激光沉積(pulsed laser deposition)利用高能激光轟擊目標材料,使得目標材料蒸發再沉積到基體材料表面,如圖4b所示。通常可以在Ti及鈦合金植入體表面制造涂層、薄膜和不同的微觀納米結構,如納米孔、納米管、納米粉末、量子點等,具體的結構取決于脈沖激光沉積的激光功率、氣體氛圍等工藝參數。對于沉積的涂層和薄膜,一般選取可以改善Ti及鈦合金生物惰性的材料,如磷酸鈣基材料(如羥基磷灰石)、SiO2、45S5生物陶瓷、部分穩定氧化鋯(PSZ)陶瓷等,并且可以在沉積的同時進行摻雜,這些材料具有很好的生物相容性,可以加快植入體和周圍人體組織環境的融合,提高植入體力學性能、耐蝕性能[67~73]。而沉積微觀納米結構往往是為了提高表面粗糙度,成為藥物載體等。
該方法對靶材的種類沒有限制,制備的薄膜或涂層的成分可控、分布均勻,具有較大的兼容性。但是,由于激光輸出功率有限,無法制備大面積的薄膜或者涂層,因此適用于Ti及鈦合金局部改性或者特定位置改性處理,應用范圍受限。改善激光功率,制備大面積薄膜或涂層是該方法未來的主要發展方向。
電子束物理氣相沉積(physical vapor deposition)是在真空條件下通過電子束將所需的材料源進行氣化,變為氣態原子或分子狀態,或電離為離子狀態,然后沉積在目標基體表面形成具有某種特殊功能的薄膜的技術。其原理類似于脈沖激光沉積。在Ti及鈦合金表面處理中,常用來沉積生物活性物質如類骨骼成分磷灰石薄膜,以提高合金表面的生物活性,加快合金植入體和周邊人體組織的結合速率。Gnanavel等[74]利用電子束物理氣相沉積技術在β型鈦合金Ti-13Nb-13Zr表面沉積了磷灰石薄膜,相比于沒有沉積磷灰石的合金,沉積了磷灰石薄膜的合金具有更好的耐腐蝕性能。值得注意的是,沉積磷灰石薄膜增強了合金的生物活性,利于成骨細胞的黏附、增殖,表現出了良好的細胞活性和生物相容性,并且毒性降到最低。Kaliaraj等[75]在Ti基體上沉積了Y穩定ZrO2涂層,相比于不規則的Ti表面,涂層表面為均勻而致密的顆粒,平均粗糙度由Ti的4.55 nm降為2.99 nm,粗糙度的降低抑制了細菌的黏附,但是也降低了成骨細胞的黏附。45 d生物礦化研究顯示,Y穩定ZrO2涂層比純Ti表現出更多的成核位點,額外形成了磷灰石,同時涂層還增加了對血液蛋白的黏附力。提高涂層表面粗糙度和抗菌性能是改進Y穩定ZrO2涂層的下一步目標。
電子束物理氣相沉積制備的薄膜致密均勻,與基體結合緊密,且制備工藝簡單、耗材少,對環境友好,適合工業化大規模使用。
與沉積方法制備的涂層不同,化學轉化(chemical synthesis)方法是在基底表面通過原位轉化的方式生長涂層,涂層與基底之間往往有著更強的結合力,涂層與基底之間的緊密結合避免了植入體在人體中長時間存在可能導致的涂層與基底分離的問題。該方法要在基底上制備可有效提高植入體表面生物活性的材料,如最典型的與天然骨骼成分相似的Ca3(PO4)2、磷灰石[76~78]。Liu等[79]通過化學轉化技術在純Ti和Ti-6Al-4V合金基底上原位轉化制備了磷鈣鋅礦涂層,2種基底上的涂層均由納米片構成。該方法制備的涂層與基底具有強結合力,使得材料在0.9%NaCl溶液中都具有良好的耐蝕性,尤其在Ti-6Al-4V合金基底上制備的涂層由于其更加致密和均勻的結構表現更佳。在體外成骨細胞MG63細胞培養實驗表明,磷鈣鋅礦涂層具有良好的細胞相容性。Yu等[80]通過化學轉化在純Ti表面制備了殼聚糖、銀和羥基磷灰石,再通過旋涂的方法在涂層的表面涂覆了一層溶菌酶,形成了復合涂層。該涂層為多孔分層的納米結構,有利于細胞的黏附和增殖。涂層組分均具有很低的毒性,其中殼聚糖、銀以及溶菌酶的協同作用顯示出了12 h內對大腸桿菌和金黃色葡萄球菌高達95.28%和98.02%的抗菌效率。Liu等[81]通過水熱合成的化學轉化方法在具有低Young's模量的β型鈦合金Ti-24Nb-4Zr-7.9Sn表面制備了納米TiO2涂層,該涂層提高了鈦合金表面的粗糙度,增加了表面親和力,促進了細胞的黏附和增殖。體內實驗顯示納米TiO2在皮下和骨內植入具有更好的組織相容性,同時可以增強早期骨整合。Zhang等[82]通過逐層自組裝的方法在Ti-24Nb-2Zr合金上制備了多巴胺修飾的透明質酸/殼聚糖生物活性多層涂層,該復合涂層顯著降低了接觸角并提高了合金的潤濕性。體外成骨細胞增殖測試表明,添加涂層后成骨細胞增殖明顯高于原始合金,有效提高了生物相容性。
化學轉化方法是一種簡單有效的表面涂層制備方法,有著低成本、污染小、易于制備、適用性廣等優點;缺點為制備的涂層形貌、厚度等較難控制,重復性較差。
電化學陽極氧化(electrochemical anodizing)方法通過將電能轉化為化學能,使陽極和陰極發生化學反應,尤其對于陽極,通過合理調控施加電位、電流強度、氧化時間等條件,可以改變陽極的微觀形貌[83,84]。如圖4c所示,將Ti及鈦合金植入體作為陽極,利用電化學陽極氧化可以在植入體表面制備微米級、納米級表面形貌以及納米管、納米孔等微觀結構。微米級表面形貌可以促進成骨細胞分化[85,86],納米級表面形貌則促進細胞增殖[87],2者結合可以促進成骨細胞的增殖和分化[88];微觀結構有利于Ti及鈦合金被植入后正常細胞的黏附增殖、結構抑菌、充當藥物載體等。Huang等[89]將AgNO3電解質改為Cu(NO3)2電解質,在Ti基底上制備了微/納米紋理表面,并且生長了TiO2介孔陣列,電解質的改變避免了金屬陽離子摻入納米陣列帶來的潛在細胞毒性,提高了細胞相容性,同時在電解質中加入Na3PO4會促使 P的摻入,也可以進一步改善其細胞相容性,而自身的微/納米紋理表面又促進了細胞的增殖和分化。Hu等[90]通過陽極氧化在Ti表面制備了TiO2納米管,很好地改善了細胞黏附和骨整合。Lee等[91]通過兩步陽極氧化制備的TiO2納米管陣列,在促進骨整合的同時還可以作為重組人骨形態發生蛋白的載體。Su等[92]證實了TiO2納米管在機械抑菌方面的積極作用。Kim等[93]對Ti陽極氧化后形成的TiO2納米管進行了堿處理和熱處理,堿處理后的納米管轉變為納米纖維結構,增加了表面粗糙度以及親水性;熱處理后會促進體液中離子和TiO2納米管表面Na+交換,加速骨狀磷灰石的形成;堿和熱處理還有效促進了成骨細胞在植入體表面的擴散。Kang等[94]通過陽極氧化制備了納米結構TiO2,并在不同濃度的NaCl溶液中進行了二次陽極氧化以將Cl-摻入TiO2中,在具有細胞相容性的同時賦予了材料抗菌性能。Liang等[95]在Ti-4Zr-22Nb-2Sn合金表面通過電化學陽極氧化制備了自支撐納米管層,顯著增加了合金表面粗糙度。
電化學陽極氧化制備表面結構具有可控性高、形貌多樣化、反應速率快、成本低等優點,并且可以根據用途(如提高表面粗糙度、充當藥物載體等)設計表面結構,應用十分廣泛。
等離子體電解氧化/微弧氧化(plasma electrolytic oxidation/micro-arc oxidation)來源于陽極氧化技術,區別在于在電極上是否施加了高壓,如圖4c所示。將目標合金放入特定的電解液中作為電極,并放置對電極,通過調節電參數,使得在電解液中的目標合金表面產生弧光放電,在極短的時間內達到高溫高壓狀態,生長出以基底合金材料的氧化物為主的陶瓷膜層。生長的陶瓷膜層往往具有高硬度、耐腐蝕、耐磨損等優點。Shin等[96]制備純Ti的氧化層時在電解液中添加了Ag納米顆粒,Ag納米顆粒參與了Ti的氧化過程,形成了含有Ag的多孔鈦氧化層。其中,含有0.1 g/L Ag納米顆粒的電解質下形成的氧化層顯示了更好的生物活性和抗菌性能。Kalu?erovi?等[97]在NaOH和Ca(H2PO4)2水溶液中進行等離子體電解氧化制備了3種具有金紅石型TiO2表面的新型陽極轉化層,同時還存在生物活性陶瓷成分鈦酸鹽和無定形Ca3(PO4)2,這些表面物質共同促進了骨組織的形成和生長,尤其適用于牙科領域。Wang等[98]在Ti基底噴砂處理的基礎上進行了等離子體電解氧化,形成了多孔的、含Ca和P的涂層,這種組合處理方式不僅保留了合金表面微觀的多孔結構,Ca和P的存在還促進了羥基磷灰石在涂層上的形成,增強了細胞活力。Hong等[99]在Ti-6Al-4V合金上通過微弧氧化制備了TiO2和羥基磷灰石薄膜,薄膜與基底結合強度高,不受薄膜厚度和形貌影響;且該薄膜具有良好的生物活性和細胞黏附能力,細胞實驗顯示,成骨細胞MC3T3-E1細胞的附著和增殖受到了薄膜中Ca2+和P5+濃度以及電解質組分的影響。Wang等[100]結合磁控濺射和微弧氧化2種方法在Ti-6Al-4V合金基底上制備了Zn/ZrO2/TiO2涂層,該涂層顯示出優異的耐腐蝕性能、細胞相容性和抗菌性能。Matos等[101]對比了微弧放電和輝光放電等離子體2種方法處理純Ti表面的差別。輝光放電等離子體處理產生硅基光滑薄膜,增加了純Ti的濕潤性,保持了Ti表面的粗糙度;微弧氧化處理產生富含Ca和P的氧化膜,具有火山外觀,增加了純Ti表面粗糙度,并產生銳鈦礦和金紅石表面TiO2晶體結構,還略微降低了早期生物膜中微生物的數量,對細胞增殖也有一定促進作用。
相比于陽極氧化,等離子體電解氧化/微弧氧化由于電壓、電流更大,反應速率更快,制備的產物往往為陶瓷涂層,在兼具生物活性的同時,硬度、耐磨損性能、耐熱性能等也得到了提升,通過該方法進行表面改性的Ti及鈦合金適用于植入人體易磨損的部位(如關節)等。
微型核糖核酸(microRNAs/miRNAs)可以調節成骨細胞的增殖和分化,因而作為一種新的成骨基因治療(gene therapy)方法(圖4d)。一些miRNAs已被證明在骨細胞調節中具有重要作用。例如,miRNA-335-5p可以促進成骨分化[102];miRNA-26a可以增強骨形成[103];miRNA-29b促進成骨因子基因表達并促進成骨細胞分化[104]。因此,將miRNA與Ti植入體結合是一種可行的策略,可以提高植入體的表面生物活性。與脫氧核糖核酸(DNA)表達相比,miRNA表達沒有整合到宿主基因組中的風險,不需要免疫誘導載體,而且其表達是可調節的和快速的。Meng等[105]開發了一種含有miRNA-29b的生物降解涂層來修飾Ti表面,該涂層不僅有利于細胞的黏附和生長,而且還提供了足夠的miRNA轉錄效果和骨誘導潛力,增強了骨表面的骨再生,提高了植入體的生物相容性。Geng等[106]通過水熱方法在Ti基底上沉積了Sr取代羥基磷灰石并固定了miRNA-21納米膠囊,制備了具有良好的超親水性涂層。體外實驗表明這種復合涂層有利于成骨細胞的增殖、分化和礦化。Geng等[107]還通過對Ti表面進行酸處理和原位聚合方法,將miRNA-21納米膠囊固定在Ti表面,形成涂層。該涂層表現出均勻的miRNA-21分布和可持續的 miRNA-21釋放。體外研究表明,miRNA-21可以促進間充質干細胞的血管生成和成骨分化,但也增強了破骨細胞活性。miRNA-21納米膠囊涂層加速了血管形成、骨重塑和骨成熟,從而顯著改善骨-植入體的接觸和增強骨-植入體結合強度。Zhang等[108]將多巴胺修飾的海藻酸鹽和miRNA固定在Ti表面并形成多層涂層,多層涂層既可以有效原位遞送miRNA,又顯著增強了細胞增殖,同時也增強了堿性磷酸酶活性,促進了成骨細胞增殖和早期分化。
microRNAs基因治療不同于其他方法,其作用本質在于提高成骨細胞的細胞活性,而非Ti及鈦合金植入體的生物活性。在使用microRNAs基因治療的同時應結合具有一定表面粗糙度或者良好生物活性的Ti及鈦合金植入體,以便更好地發揮基因治療的作用。
其他用于改善Ti及鈦合金表面生物相容性方法包括堿熱處理(alkali heat treatment)、磁控濺射 (magnetron sputtering)等。Shahriyari等[109]對退火和摩擦硬化后的Ti-6Al-4V合金進行了堿熱處理,在表面獲得了精細、均勻的納米網絡結構,增加了材料表面的濕潤性并改善了其生物相容性,表現為細胞在材料上可以完全擴散、穩定的附著以及具有更高的生物活性。Sun等[110]在堿熱處理后得到的多孔Ti表面使用天然交聯劑京尼平(genipin)固定了骨形態發生蛋白,該蛋白在基底上具有良好的附著力,并增加了材料親水性和蛋白質吸附性,且無細胞毒性。多孔的形貌則促進了細胞的黏附、增殖和礦化。Hu等[111]通過對Ti-10Zr-36Cu-14Pd合金進行酸和堿的共同處理,制備了表面多孔結構,該多孔表面可以誘導模擬體液中磷灰石的形成,提高合金生物活性。Chen等[112]采用磁控濺射法在Ti-6Al-4V合金上制備了Ca3(PO4)2和Ti梯度膜。相比于單獨的Ca3(PO4)2膜,梯度濺射退火羥基磷灰石/Ti薄膜的拉伸黏合強度約為35 MPa,顯著提高。納米壓痕實驗結果表明,梯度羥基磷灰石/鈦薄膜的Young's模量和顯微硬度也呈梯度分布,應變回復明顯優于單片羥基磷灰石薄膜。同時,羥基磷灰石/Ti薄膜使得合金表面粗糙度增加,Ca3(PO4)2的存在可以改善表面的生物活性。
僅以提高Ti及鈦合金的表面粗糙度為目的的方法往往較為簡易、成本低,如噴砂酸蝕、激光表面紋理化等,但是對于具有多功能化的Ti及鈦合金,這些方法的處理往往是不夠的;在具有一定表面粗糙度的基礎上,生物活性涂層的制備可以讓Ti及鈦合金表面成分類似于人體骨骼成分,2者的協同作用可以顯著提高Ti及鈦合金的生物相容性,使Ti及鈦合金同時具有粗糙度和生物活性的方法有等離子噴涂、脈沖激光沉積、電子束物理氣相沉積、化學轉化等;等離子體電解氧化/微弧氧化在提高Ti及鈦合金表面粗糙度以及生物活性的同時,還可以提升合金表面性能,該方法可以同時滿足Ti及鈦合金表面改性的多種需求,簡化加工處理工藝,具有較大的應用潛力;電化學陽極氧化制備的表面結構可以使Ti及鈦合金表面具有多種功能,表面結構既可以提高粗糙度,又可以作為藥物、金屬離子、基因治療因子等的載體,使合金兼具生物相容性、抗菌性能,方法簡單、成本低,適合廣泛應用。在具備生物相容性的表面改性處理的基礎上,讓Ti及鈦合金提升力學性能、抑菌/抗菌性能,是以上這些方法改進的方向。
Ti及鈦合金植入體表面的超疏水性取決于表面微觀結構和化學成分[115,116]。超疏水性表面抑菌(superhydrophobic surface antibacterial)主要通過在植入體表面構建超疏水性結構、涂層或者結合超疏水性物質,使得植入體整體呈現出超疏水特性和自清潔特性,這些特性可以有效消除細菌適宜的濕潤的生存環境,抑制細菌黏附繁殖,如圖5a1所示。同時,超疏水性還可以減少植入體在植入后血液中血小板的黏附和蛋白質的吸附、提高血液相容性和抗凝特性[117]。Tang等[118]在Ti植入體表面制備TiO2納米管,其具有接觸角大于150°的超疏水性,有效防止細菌在植入體表面黏附。在鈦合金表面通過高速微銑削構建微槽、陽極氧化制備納米管陣列、氟烷基硅烷自組裝構建涂層改性后,由于物理形態和化學改性的協同作用,尤其是氟烷基硅烷的存在降低了表面自由能,使得植入體整體表面顯示出超疏水性[119]。在牙科應用中,疏水表面可以有效防止牙釉質腐蝕,增加牙齒的自清潔能力,保持牙齒健康[120]。
圖5 超疏水性抑菌、親水性抑菌、表面仿生結構抑菌示意圖及藥物抗菌、正電荷物質抗菌、金屬離子抗菌示意圖
Fig.5 Schematics of superhydrophobic antibacterial (a1), hydrophilic antibacterial (a2), and surface biomimetic structure antibacterial (a3); drugs antibacterial (b1), positively charged materials antibacterial (b2), and metal ions antibacterial (b3)
超疏水性表面在抑制細菌黏附、生長的同時,也會抑制正常細胞的黏附、生長,作為骨骼替代物還需通過增加表面粗糙度、制備生物活性涂層等方式進一步加工后才可以使用,因此主要應用于牙科領域。
表面親水性聚合物抑菌(surface hydrophilic polymer antibacterial)與表面超疏水性抑菌都旨在從源頭阻斷細菌感染,避免了細菌感染后藥物治療帶來的負面影響。如抗生素的頻繁、過度使用往往會導致細菌耐藥性提高,后續抗生素效果變弱。不使用抗生素去抗菌抑菌是新的植入體表面改性思路[121]。鈦合金表面涂覆聚合物,例如聚乙二醇及其衍生物,是有效防止細菌黏附的方法,如圖5a2所示,其原理是細菌在疏水性表面具有強的黏附力,而在親水性表面黏附力會大大減弱,而聚合物具有強的親水性[122~124]。在聚合物上進行功能設計,如添加抗菌陽離子、細胞黏附肽層等,在防止細菌污染的同時可以殺死細菌,并促進細胞黏附和成骨行為,消除聚合物親水性帶來的過度影響[125~127]。
與超疏水性抑菌缺點類似,親水性表面在抑制細菌黏附時也會減弱細胞的黏附,改善親水性表面的生物相容性是該方法的主要研究方向。
表面仿生納米結構抑菌(surface biomimetic nanostructures antibacterial)的靈感來源于自然界生物某些部位的微觀納米結構,如蝴蝶翅膀上納米棒簇可以制造多種顏色的結構色,蜻蜓翅膀、蟬翼表面的納米梳結構可以有效抑菌,如圖5a3所示。仿生納米結構抑菌是一種物理方式抑菌,主要利用獨特的表面納米結構的接觸抑菌特性,細菌在接觸到植入體表面時很容易被表面納米結構擠壓、撕裂,進而抑制細菌在植入體表面的長時間黏附、增殖[128,129]。在Ti及鈦合金植入體表面形成納米柱(如TiO2納米柱)、納米棒(如ZnO納米棒)、納米管、納米錐、納米刺以及其他納米結構都可以有效地破壞細菌適宜的生存環境,主要是通過物理的、機械的方式破壞細菌膜和細菌細胞組織,抑制細菌細胞分裂。同樣地,在納米結構中加入抗菌陽離子、促進組織細胞黏附物質和成骨因子,可以在物理結構抑菌的同時釋放抗菌陽離子,加快細菌的滅亡,并且不影響甚至促進人體細胞組織的生長[130~133]。
表面仿生納米結構抑菌的主要優勢在于其具有抑菌持續性,在抑菌過程中不會造成自身損耗,相比于通過釋放藥物、特定的酶等因子抗菌方法的持續時間更久;而且自身的納米結構也有利于細胞的黏附。該方法可以減緩甚至避免植入體的二次手術風險。
表面非特異性酶抑菌(surface non-specific enzyme antibacterial)是通過對鈦合金植入體表面涂層添加可以降解、破壞細菌細胞表面組織的酶進而抑制細菌的方法。主要是天然的或人工合成的DNase I酶,其抑菌作用機理是通過水解胞外DNA的磷酸二酯鍵以破壞其局部結構,而胞外DNA是細菌黏附鈦合金植入體的重要物質,胞外DNA可以通過結合細胞外蛋白質、多糖的方式穩定生物膜。DNase I酶降解胞外DNA后,會阻礙細菌與環境中的蛋白質和多糖結合,抑制細菌黏附,防止生物膜的形成[134~136]。DNase I酶的使用不會使細菌產生耐藥性,但是酶的作用范圍有限,無法抑制游離的細菌,持續時間也相對較短,不超過24 h。解決的可行辦法是與抗生素或其他抗菌物質協同抑菌抗菌[137,138]。
表面非特異性酶抑菌對細菌具有針對性,抑制細菌的同時不會對人體細胞產生負面影響;其缺點也較為明顯,可持續時間較短,無法抵抗細菌多次感染。
在細菌的生長過程中,伴隨著細菌群落的不斷擴張、細菌密度的不斷增加,群落會影響個體細菌的生理功能,而細菌個體會通過分泌化學信號分子來檢測和適應菌落的變化,這種細菌與菌落的信息交流系統稱為細菌群體感應系統。細菌群體感應系統不僅會使細菌生成抵抗抗生素的生物膜,而且會激發細菌產生毒性因子。群體感應抑制劑(quorum sensing inhibitor)本身不具有殺菌的能力,而是以細菌群體感應系統為靶目標,降解其產生的信號分子并抑制其形成生物膜,減弱細菌群落的耐藥性,降低細菌的毒性[139~142]。許多動植物、微生物均可以產生特定的群體感應抑制劑,也可以通過化工合成方式制備所需的群體感應抑制劑。但是,群體感應抑制劑不足以殺死細菌,往往需要與其他功能物質組合使用。例如結合抗生素使用可以提高抗生素的抗菌作用[143],結合聚合物共同負載到Ag納米粒子上可以在抗菌的同時提高成骨細胞生長能力[144]。
群體感應抑制劑往往作為抗菌的輔助因子,以提高抗菌效果。
表面藥物抗菌比全身給藥的抗菌方式更加精準、靈活,但是表面負載的藥物數量有限,面對頻繁細菌感染時消耗更快且無法進行藥物補充,使用壽命隨細菌感染次數的增多而縮短,抗菌持續性較差。
細菌表面蛋白質的基礎單元氨基酸可解離為帶負電的羧基和帶正電的氨基,而細菌生長環境的pH值通常高于細菌表面氨基酸的等電點(分子表面不帶電荷時的pH值),因而細菌總帶負電。表面正電荷物質抗菌(surface positive charges antibacterial)正是利用細菌帶負電這一特性,在Ti及鈦合金表面涂覆帶正電荷物質,通過靜電相互作用破壞細菌細胞壁的完整性,進而達到殺菌的目的,如圖5b2所示。用于合金表面帶正電荷的物質主要有生物多糖,如殼聚糖[157~159];聚合陽離子,如聚乙烯亞胺衍生物、ε-聚-l-賴氨酸[123,160,161];陽離子季銨化合物[162~165]等,其中抗菌肽作為新型的抗菌劑,除了與細菌表面產生靜電作用外,腺嘌呤核糖核苷酸還會破壞細菌的磷脂雙分子層,導致細菌細胞質流出進而死亡[166]。這些物質均可以容易地錨定在合金表面進而發揮作用。
表面正電荷物質由于其被錨定在合金表面,在抗菌過程中損耗較少,因此可持續性更好。該方法已被廣泛應用于衣物表面抗菌,在Ti及鈦合金植入體表面抗菌方面非常具有潛力。
鈦合金植入體表面釋放金屬離子抗菌(metal ions antibacterial)是直接有力的方法,其作用范圍廣、效率高,在殺死細菌的同時,不同的金屬離子具有提高鈦合金植入體的生物相容性、促進骨細胞增殖等多種功能,如圖5b3所示。抗菌金屬元素有Au、Ag、Cu、Zn、Ga等[167~177]。其中,主流的抗菌金屬元素是Ag,在Ti表面上的存在形式有納米顆粒沉積、嵌入大分子涂層、負載在TiO2納米管中、多巴胺固定等[178~180]。在進行抗菌行為時,Ti表面的Ag納米顆粒會源源不斷地釋放Ag+,在植入體表層附近擴散開來。當接觸到細菌時,Ag+會破壞細菌膜的通透性,進入細菌細胞質中引起重要蛋白質如DNA失活,進而達到滅菌的效果[145]。為了提高負載Ag的Ti植入體的生物相容性,可以在負載Ag的同時負載具有促進細胞增殖的功能離子[179]。
金屬離子可以殺死多種病毒、細菌,滅菌率高,持續時間長,并且不會產生耐藥性,是非常理想的抗菌手段。現已有金屬離子抗菌劑應用于臨床。需要注意的是,過量的金屬離子與人體血液中的物質反應會產生一定的毒性,對金屬離子抗菌劑的使用條件應更加嚴苛。
為了避免Ti及鈦合金植入體表面功能藥物隨時間推移含量減少、功效減弱和失效帶來后續的重新修復,可以在植入體表面長久發揮功效的表面處理方法更容易被接受。光熱抗菌(photothermal antibacterial)是長久有效的方法。光熱抗菌的前提是可以在植入體表面形成長久穩定的光響應涂層,在抗菌治療中,對植入體部位進行可見光(660 nm)或近紅外光(808 nm)照射,可以激發植入體表面光響應涂層的光熱效應,產生局部的活性氧(reactive oxygen species,ROS),進而殺死細菌,如圖6a所示。可激發光熱效應的材料有碳基納米材料、納米Au、CuS、MoS2、聚多巴胺等[186~190]。遺憾的是,光熱抗菌的效果極其有限,徹底的殺菌往往需要相對高溫和長時間的光照,而在該條件下正常的人體組織細胞也會被殺死[191]。因此,光熱抗菌仍然不能單獨使用,在固有的治療條件下需要結合協同殺菌物質和利于修復的成分。例如光響應材料MoS2與聚多巴胺-精氨酸-甘氨酸-天冬氨酸結合,在MoS2通過程度相對溫和的光熱效應殺死細菌的同時,聚多巴胺-精氨酸-甘氨酸-天冬氨酸可以促進間充質干細胞的增殖分化,加快組織的修復[192];由聚多巴胺、氧化石墨烯、Ag納米粒子和膠原蛋白形成的復合涂層中,在聚多巴胺、氧化石墨烯、Ag納米粒子協同抗菌的同時,膠原蛋白可以提高植入體的生物相容性[193]。
圖6 光熱抗菌、光動力抗菌、光聲抗菌示意圖
Fig.6 Schematics of photothermal antibacterial (a), photodynamic antibacterial (b), and photoacoustic antibacterial (c) (ROS—reactive oxygen species, 1O2—singlet oxygen)
光熱抗菌和光動力抗菌均需要調控適當的反應條件和時間,在溫和的條件下2者的殺菌效果都會減弱,因此需要結合使用以在盡可能溫和的條件下提高抗菌效果,協同抗菌[113,114,198,199]。在追求高效的抗菌效率時,往往還需要加入細胞組織修復劑。Li等[113]在Ti植入體表面同時構建了包含紅磷、MoS2的光響應涂層和光敏劑IR780,并加入輔助劑聚多巴胺。2者的結合使用可以殺死細菌,破壞細菌膜,輔助劑聚多巴胺又可以促進正常細胞的黏附和生長。Yuan等[199]制備了介孔聚多巴胺、光敏劑吲哚青綠以及精氨酸-甘氨酸-天冬氨酸修飾的鈦復合材料,在近紅外光照射下,光敏劑和光響應材料有效殺死細菌,消除細菌膜。而精氨酸-甘氨酸-天冬氨酸的存在也使殺菌后的細胞修復得到保障。
光熱抗菌、光動力抗菌以及光聲抗菌的主要優勢是抗菌的長久持續性,有效避免了抗菌成分失效導致的二次手術,減輕了患者的痛苦。這類型方法的缺點也較為明顯,在外源治療過程中殺死細菌的同時會造成細胞損傷,溫和的條件又無法完全殺死細菌,尋找最佳治療條件以及配合其他方法抗菌是目前主要的解決辦法。
抑菌手段旨在消除細菌適宜的生存環境,從根源上讓細菌無法在Ti及鈦合金表面黏附、生長,如在Ti及鈦合金表面構建超疏水性涂層、親水性聚合物、仿生納米結構,然而,這些方法在抑制細菌黏附的同時也會在一定程度上抑制細胞的黏附,需要通過改變表面粗糙度、提高表面生物活性以彌補它們的不足;或者針對細菌使用非特異性酶、群體感應抑制劑,破環細菌局部結構,降低其耐藥性,抑制細菌進一步生長。抗菌手段則是直接對細菌進行滅活處理,Ti及鈦合金植入體表面藥物抗菌、金屬離子抗菌在效果上雖然顯著,但是其抗菌因子均為消耗性物質,無法保持長效;而在植入體表面錨定正電荷物質大大減少了抗菌因子的消耗,具有長久持續性;同樣地,通過在Ti及鈦合金表面構建可長久存在的光熱、光聲響應涂層,再由外源信號激活響應涂層進行殺菌的方法有效提高了抗菌的長效性,但是殺菌效果方面還需進一步改善。
Ti及鈦合金在生物醫用領域的研究,主要分為力學性能提升,生物相容性改善,植入體表面具有抑菌、抗菌性3個方向:(1) 力學性能的提升旨在使Ti及鈦合金具有類骨骼性質,如接近骨骼的Young's模量,同時還要具有高的強度、硬度,抗磨損,耐體液腐蝕等性質,以保證植入體在人體中可以長久存在且不會產生有毒物質,誘發炎癥。目前研究的多種鈦合金可以在多種力學性能中達到最佳平衡狀態,即可以同時滿足多種力學性能要求,但是無法讓每種力學性能都達到最佳。后續研究的目標集中在提升鈦合金多種力學性能的最佳平衡狀態;(2) 在提升Ti及鈦合金力學性能的同時,其生物相容性的改善也是不可或缺的。生物相容性的缺失會導致合金在植入人體后久久無法與人體骨骼、周圍組織緊密結合,造成植入體松動、疲勞等問題,給患者帶來巨大的痛苦。研究者通過提高鈦合金表面粗糙度和制備生物活性物質涂層2種主要途徑已有效提高了鈦合金的生物相容性。但是,只具有良好的生物相容性的鈦合金遠遠無法滿足實際應用需求;(3) 即便Ti及鈦合金可以長期穩定存在于人體內且與人體周圍組織結合緊密,細菌感染問題仍然無法避免。目前以及未來的發展,仍然需要聚焦于更容易引發炎癥、造成生命威脅的細菌感染方面,即植入體表面抑菌、抗菌領域。無論是在Ti及鈦合金表面負載抑菌/抗菌因子,還是構建外源響應涂層,在植入人體后都很難保持其持續有效性以及對人體自身細胞組織的長期無害性。
Ti及鈦合金某一方面的性能提升很難長期有效地滿足實際應用的多種需求。因此,研究者需要在Ti及鈦合金力學性能、生物相容性以及具備抗菌性3者之間達到最佳平衡狀態。即在兼顧良好的力學性能、良好的生物相容性的同時,術后無需二次手術的、長久有效的抗菌策略是Ti及鈦合金在生物醫用領域中未來研究的主要方向。
1 成分設計和表面改性提升Ti及鈦合金力學及耐磨損、耐腐蝕等性能
1.1 電弧熔融處理
圖1
1.2 高溫氣體熱處理及高溫熱處理
1.3 放電等離子燒結
圖2

1.4 激光表面改性
2 表面改性處理提高Ti及鈦合金表面粗糙度和生物活性
2.1 噴砂、酸蝕及其組合使用提高表面粗糙度
圖3

2.2 3D打印技術提高表面粗糙度
2.3 激光表面紋理化提高表面粗糙度
2.4 等離子噴涂提高表面粗糙度及生物活性
圖4
2.5 脈沖激光沉積提高表面粗糙度及生物活性
2.6 電子束物理氣相沉積提高表面生物活性
2.7 化學轉化制備表面涂層提高表面生物活性
2.8 電化學陽極氧化處理改變表面結構
2.9 等離子體電解氧化/微弧氧化提高表面粗糙度和生物活性
2.10 基因治療提高表面生物活性
2.11 其他方法改善Ti及鈦合金表面生物相容性
3 表面處理改性使Ti及鈦合金表面具有抑菌/殺菌性能
3.1 超疏水性表面抑菌
圖5

3.2 表面親水性聚合物抑菌
3.3 表面仿生納米結構抑菌
3.4 表面非特異性酶抑菌
3.5 表面群體感應抑制劑抑菌
3.6 表面藥物抗菌
3.7 表面正電荷物質抗菌
3.8 表面金屬離子抗菌
3.9 外源輔助抗菌
3.9.1 光熱抗菌
圖6

3.9.2 光動力抗菌
3.9.3 光聲抗菌
3.9.4 光熱光動力結合抗菌
4 Ti及鈦合金表面改性在生物醫用領域面臨的挑戰與未來的展望







 滬公網安備31011202020290號
滬公網安備31011202020290號
