分享:共晶高熵合金AlCoCrFeNi2.1 在H2SO4 溶液中的腐蝕行為
胡文濱, 張曉雯, 宋龍飛 ,, 廖伯凱, 萬閃, 康磊, 郭興蓬
,, 廖伯凱, 萬閃, 康磊, 郭興蓬 ,
,
利用電化學測試、SEM、EDS、XPS等方法研究了AlCoCrFeNi2.1共晶高熵合金(EHEA)在0.05 mol/L H2SO4溶液與0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的腐蝕行為。結果表明,AlCoCrFeNi2.1 EHEA在H2SO4溶液中的鈍化行為與局部腐蝕受Cl-影響明顯;Cl-不改變AlCoCrFeNi2.1 EHEA鈍化膜的半導體類型,但對鈍化膜的致密性影響明顯;鈍化膜中的Ni受Cl-影響較小,Cl-主要通過影響Al、Cr氧化物的含量進而改變鈍化膜的性質;在0.05 mol/L H2SO4溶液中,AlCoCrFeNi2.1 EHEA的腐蝕為富Ni-Al相選擇性溶解;在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中,則為點蝕與選擇性溶解。
高熵合金(HEA)打破傳統的單主元合金設計理念,以多主元為思路,成為合金研究的新熱點[1]。其中,AlCoCrFeNi2.1 (原子分數,%)共晶高熵合金(EHEA)是一種具有優異力學性能的新型HEA,自2014年被Lu等[2]首次報道后在材料領域得到廣泛關注。目前,AlCoCrFeNi2.1 EHEA的研究主要集中于力學性能方面,對于其在腐蝕環境中服役失效的探討較少。環境腐蝕是新型材料安全服役的關鍵問題[3,4],研究AlCoCrFeNi2.1 EHEA的腐蝕行為對其推廣應用具有重要意義。
HEA因Cr含量超過12% (原子分數)可發生鈍化,鈍化行為是HEA腐蝕研究的重要課題。Wang等[5]發現,Co36Fe36Cr18Ni10 (原子分數,%,下同) HEA在模擬人體體液中的鈍化膜的Cr2O3 / Cr(OH)3比值高于316L不銹鋼;Xu等[6]指出,激光熔凝制備的CoCrFeMnNi HEA的鈍化膜具有較高的(Cr + Ni + Co) / (Fe + Mn)的原子比,其鈍化膜保護能力更強;Luo等[7]發現,CoCrFeMnNi HEA的鈍化膜中存在Ni元素,并指出這與不銹鋼鈍化膜組成有一定區別。然而,關于AlCoCrFeNi2.1 EHEA鈍化行為的研究鮮有報道。局部腐蝕是HEA關注的另一重點問題。Shi等[8]發現,Al元素的增加引起Alx CoCrFeNi HEA中貧Cr的bcc相的體積分數增大,導致鈍化膜致密性下降進而誘發局部腐蝕。Chai等[9]認為,多主元合金FeCoNiCrx 中過量的Cr引起的元素偏析是誘發局部腐蝕的原因。Lin和Tsai[10]認為,Al0.5CoCrFeNi HEA中的富Al-Ni相在含Cl-的環境中優先腐蝕。此外,AlCoCrFeNi2.1 EHEA由fcc相與B2相組成,兩相之間可能形成微電偶效應,存在局部腐蝕的風險。
因此,本工作采用循環極化曲線、電化學交流阻抗譜(EIS)、Mott-Schottky (M-S)曲線、掃描電子顯微鏡(SEM)和X射線光電子能譜(XPS)等方法研究AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的電化學特征、鈍化行為與局部腐蝕規律,并揭示其微觀腐蝕機理。
1 實驗方法
1.1 實驗材料與測試溶液
所用AlCoCrFeNi2.1 EHEA是以純度為99.9% (質量分數,下同)的Al、Co、Ni與純度為99.5%~99.6%的Cr、Fe為原料,真空電弧熔煉而成。AlCoCrFeNi2.1 EHEA經電火花線切割加工后,使用SiC砂紙由250~5000號逐級打磨,利用2.5 μm金剛石研磨膏機械拋光,經王水(HCl∶HNO3 = 3∶1,體積比)侵蝕后在M33OP-HD228S光學顯微鏡(OM)下觀察組織形貌。實驗使用的測試溶液為0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液。
1.2 電化學測試
用于電化學測試的AlCoCrFeNi2.1 EHEA試樣尺寸為10 mm × 10 mm × 2 mm。電化學試樣制作方法為將銅導線與試樣進行焊接,使用環氧樹脂封裝,露出10 mm × 10 mm的測試面,試樣使用SiC砂紙逐級打磨至2000號,用去離子水、無水乙醇清洗后冷風吹干。電化學測試均在CS350電化學工作站上完成,采用傳統的三電極系統,以飽和甘汞電極(SCE)作為參比電極,Pt電極作為對電極,AlCoCrFeNi2.1 EHEA作為工作電極。電化學測試前,樣品在測試溶液中浸泡1 h以保證試樣表面達到相對穩定的狀態。EIS測試頻率范圍為104~10-2 Hz,振動電位為10 mV,EIS數據利用ZsimpWin軟件擬合分析。循環極化曲線測試從-1.0 V (vs SCE)開始掃描,當電流密度達到1 mA/cm2時進行回掃,掃描速率為0.5 mV/s。為研究AlCoCrFeNi2.1 EHEA試樣的鈍化行為,對其進行恒電位極化2 h處理,參照極化曲線測試結果,電位選擇為0.1和 0.2 V (vs SCE),隨后進行M-S曲線測試,測試范圍為-1.0~1.0 V (vs SCE),頻率為103 Hz。
1.3 XPS測試
為研究鈍化膜性質,對AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中進行0.2 V (vs SCE)恒電位極化2 h以在金屬表面形成鈍化膜。然后,應用具有單色Al Kα X射線源的AXIS SUPRA+型XPS對鈍化膜的成分進行分析。數據使用標準C1s峰(284.8 eV)進行校準,并使用XPSPEAK 4.1軟件進行數據擬合。
1.4 浸泡實驗
將AlCoCrFeNi2.1 EHEA試樣分別于0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中浸泡25 d,然后,采用配備能量色散光譜儀(EDS,Xplore 30)的CLARA型SEM進行腐蝕形貌觀察與元素分布分析。
2 實驗結果
2.1 AlCoCrFeNi2.1 EHEA的微觀結構
圖1為AlCoCrFeNi2.1 EHEA的微觀組織形貌。由圖可知,AlCoCrFeNi2.1 EHEA有典型的共晶組織特征,具有層狀雙相結構,由規則與不規則2種共晶組織交替構成。普遍觀點認為該共晶組織由fcc相與B2相構成。根據先前學者[11~13]的研究,EHEA在凝固過程中會發生元素擴散進而形成金屬間化合物相和固溶體相。其中,圖中的淺灰色相為fcc固溶體相,深灰色相為B2相。本工作的AlCoCrFeNi2.1 EHEA微觀形貌與文獻[14,15]中報道的一致。
圖1

圖1 AlCoCrFeNi2.1共晶高熵合金(EHEA)顯微組織
Fig.1 Microstructure of AlCoCrFeNi2.1 eutectic high-entropy alloy (EHEA)
2.2 AlCoCrFeNi2.1 EHEA的循環極化曲線
圖2為AlCoCrFeNi2.1 EHEA分別在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的循環極化曲線,具體的電化學參數如表1所示。由圖可知,AlCoCrFeNi2.1 EHEA在2種溶液中均表現出活化-鈍化-過鈍化的行為,這與Sun等[16]測得的CrMnFeNi與CrMnFeNiLa0.1合金在不同濃度H2SO4溶液中的動電位極化曲線的現象一致。AlCoCrFeNi2.1 EHEA在2種溶液中自腐蝕電位(Ecorr)差異不大,這表明腐蝕的熱力學傾向受Cl-影響不大;極化曲線的陽極區受到Cl-影響較大,鈍化區明顯變窄,破鈍電位(Eb)下降,表明鈍化膜在含Cl-的H2SO4溶液中更容易遭到破壞。值得注意的是,維鈍電流密度(ipass)未發生明顯變化,表明少量的Cl-并未改變鈍化膜形成的勢壘;此外,Cl-對陰極反應有輕微促進作用。循環極化曲線常用于研究鈍化金屬點蝕行為的電化學機理。當曲線的回掃電流密度比正向掃描的更大時會出現回滯環,回滯環的面積越大表明點蝕傾向越大;反之則表明合金具有較好的耐點蝕性能。從圖2可知,0.05 mol/L H2SO4溶液中的循環極化曲線未出現回滯環,而在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中則出現明顯的回滯環,這表明AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中更容易發生點蝕。回滯環與陽極極化曲線的交點稱作保護電位(Eprot),在Eprot之下,已有的點蝕不會繼續生長;而在Eb與Eprot之間,已有的點蝕會繼續生長但不會出現新的點蝕,Eprot越高表明合金的耐點蝕性能越優異[17~19]。少量的Cl-導致Eprot明顯降低,耐點蝕性能下降,間接表明少量Cl-對AlCoCrFeNi2.1 EHEA鈍化膜破壞作用明顯。
圖2
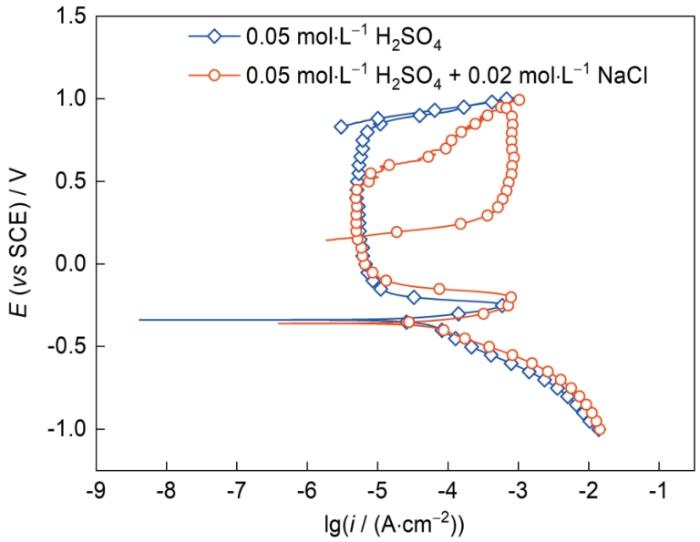
圖2 AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的循環極化曲線
Fig.2 Cyclic polarization curves of AlCoCrFeNi2.1 EHEA in 0.05 mol/L H2SO4 solution and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution (E—potential, i—current density)
表1 AlCoCrFeNi2.1 EHEA的電化學參數
Table 1
| Solution | Ecorr / mV | icorr / (μA·cm-2) | Eb / mV | ipass / (μA·cm-2) |
|---|---|---|---|---|
| 0.05 mol·L-1 H2SO4 | -339 | 59.012 | 778 | 4.990 |
| 0.05 mol·L-1 H2SO4 + 0.02 mol·L-1 NaCl | -360 | 67.387 | 471 | 5.048 |
2.3 AlCoCrFeNi2.1 EHEA的EIS
為進一步探討AlCoCrFeNi2.1 EHEA的表面電化學行為,測試了其在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的EIS,如圖3所示。AlCoCrFeNi2.1 EHEA在2種溶液中的Nyquist圖(圖3a)均由1個容抗弧及電感回路組成。H
圖3

圖3 AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的EIS
Fig.3 Nyquist plots (a) and Bode plots (b) of AlCoCrFeNi2.1 EHEA in 0.05 mol/L H2SO4 solut-ion and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution (Inset in Fig.3a shows the electrical equivalent circuit of EIS. Rs—solution resistance, Qdl—electrochemical response parameter of double electric layers, Rct—the charge transfer resistance, L—inductance of adsorption species, RL—inductance resistance)
式中,Y0為與頻率無關的常數,ω為角頻率,j為一個虛數,n為CPE的擬合指數項(當n = 1時代表理想的電容行為,n = 0時代表純電阻)。L和RL分別表示吸附物質的電感及其對應的電阻。擬合結果如表2所示。從表2可知,在2種溶液中的n值均小于1,表明在合金表面形成了有缺陷性質的鈍化膜,該鈍化膜表現出非理想的電容行為[7]。
表2 AlCoCrFeNi2.1 EHEA的EIS擬合參數
Table 2
| Solution | Rs / (Ω·cm2) | Qdl / (Ω-1·cm-2·s n ) | n | Rct / (Ω·cm2) | L / (H·cm2) | RL / (Ω·cm2) |
|---|---|---|---|---|---|---|
| 0.05 mol·L-1 H2SO4 | 13.00 | 9.8442 × 10-5 | 0.8739 | 308.5 | 120.8 | 67.22 |
| 0.05 mol·L-1 H2SO4 + 0.02 mol·L-1 NaCl | 17.62 | 1.6432 × 10-4 | 0.8858 | 271.3 | 18.0 | 37.70 |
2.4 AlCoCrFeNi2.1EHEA的恒電位極化曲線
圖4為AlCoCrFeNi2.1 EHEA分別在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的恒電位極化曲線。從圖可知,隨著極化的進行,電流密度在初步階段急劇下降后保持在一個相對穩定的數值(iss),這表明鈍化膜在合金表面不斷形成并逐漸致密、穩定[27,28]。0.05 mol/L H2SO4溶液的極化曲線并未出現明顯波動,而0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液的極化曲線波動較大,這表明少量的Cl-對鈍化膜的形成有不利影響。2種極化電位下0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液的極化曲線中的iss均比0.05 mol/L H2SO4溶液的更大。有研究[29]表明,iss越大鈍化膜的保護性能越差。
圖4
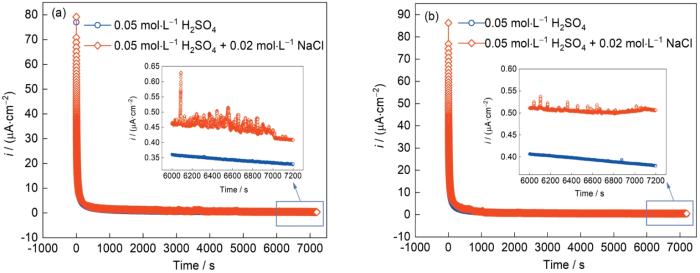
圖4 AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的恒電位極化曲線
Fig.4 Potentiostatic polarization curves of AlCoCrFeNi2.1 EHEA in 0.05 mol/L H2SO4 solution and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution at 0.1 V (vs SCE) (a) and 0.2 V (vs SCE) (b) (Insets show the partial enlargement of potentiostatic polarization curves)
2.5 AlCoCrFeNi2.1EHEA的M-S曲線
為研究AlCoCrFeNi2.1 EHEA鈍化膜的性質,分別測試了其在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中恒電位極化后的M-S曲線,如圖5所示。M-S曲線常用于金屬表面鈍化膜半導體性質的分析[30]。應用空間電荷電容(C)與外加電位(E)的關系可用
圖5
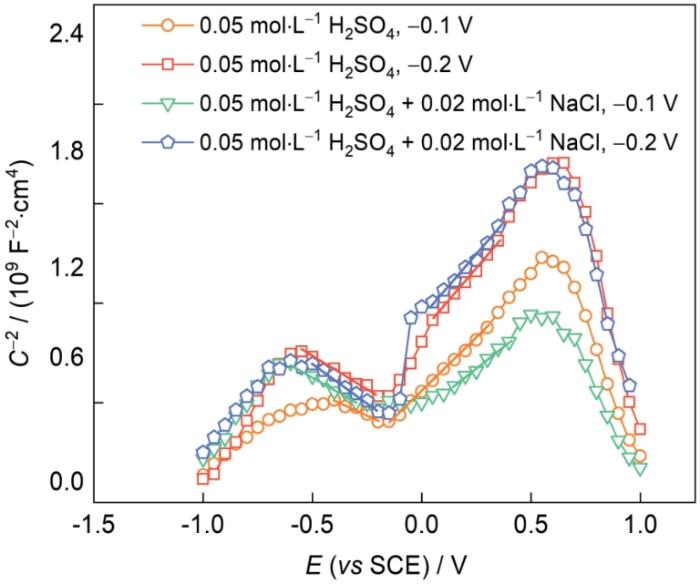
圖5 AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的M-S曲線
Fig.5 Mott-Schottky (M-S) plots for AlCoCrFeNi2.1 EHEA in 0.05 mol/L H2SO4 solution and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution (C-2—space charge capacitance)
式中,e為電子電荷,1.602 × 10-19 C;ε為鈍化膜的介電常數,一般為15.6;ε0為真空介電常數,8.854 × 10-14 F/cm;k為Boltzmann常數,1.38 × 10-23 J/K;Efb和T分別為平帶電位和熱力學溫度。
由圖5可知,AlCoCrFeNi2.1 EHEA在不同電位不同溶液中的M-S曲線線型相似,均可分成2個區域,其中正斜率部分表示鈍化膜呈現n型半導體性質,表明鈍化膜中的主要缺陷為陽離子間隙或氧空位;負斜率部分表示鈍化膜呈現p型半導體性質,表明鈍化膜中主要缺陷為陽離子空位。通常,n型半導體與p型半導體分別對應鈍化膜的內層與外層[30]。相對應的載流子密度(N)分別為施主密度(ND)和受主密度(NA),ND和NA可通過M-S曲線的線性區域斜率與
表3 AlCoCrFeNi2.1 EHEA以不同電位恒電位極化2 h后的受主密度和施主密度
Table 3
| Solution | E / V | NA / (1022 cm-3) | ND / (1021 cm-3) | Efb / V |
|---|---|---|---|---|
| 0.05 mol·L-1 H2SO4 | 0.1 | 1.8 | 8.6 | -0.53 |
| 0.2 | 1.5 | 6.9 | -0.65 | |
| 0.05 mol·L-1 H2SO4 + 0.02 mol·L-1 NaCl | 0.1 | 1.4 | 10.0 | -0.50 |
| 0.2 | 1.1 | 7.4 | -0.77 |
2.6 AlCoCrFeNi2.1EHEA浸泡后的形貌及成分
圖6為AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中浸泡25 d的微觀腐蝕形貌。由圖可知,浸泡在0.05 mol/L H2SO4溶液中的AlCoCrFeNi2.1 EHEA的表面出現選擇性溶解,沒有出現點蝕現象(圖6a);浸泡在0.05 mol/L H2SO4 + 0.02 mol/L NaCl 溶液中的AlCoCrFeNi2.1 EHEA的表面同時存在較深的點蝕坑及選擇性溶解(圖6b)。
圖6

圖6 AlCoCrFeNi2.1 EHEA浸泡在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液25 d后的SEM像
Fig.6 SEM images of AlCoCrFeNi2.1 EHEA after immersion in 0.05 mol/L H2SO4 solution (a) and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution (b) for 25 d
為進一步研究AlCoCrFeNi2.1 EHEA在0.05 mol/LH2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的局部腐蝕行為,采用EDS對其腐蝕表面的元素分布進行分析,結果如圖7所示。由圖可知,點蝕與選擇性溶解均發生在富Ni-Al的B2相,富Cr的fcc相并未觀察到明顯的腐蝕現象。這是由于富Ni-Al的B2相中高含量的Al導致在B2相上形成的鈍化膜中Al2O3含量提高,使得鈍化膜致密性下降,而富Cr的fcc相形成的鈍化膜相對更致密,具有更好的保護性[8,22,35]。此外,Hasannaeimi和Mukherjee[36]研究了AlCoCrFeNi2.1 EHEA在1%NaCl溶液中的定點微電偶腐蝕,發現fcc相富Cr、Co和Fe,而B2相的Al和Ni含量高,在極化及非極化條件下B2相的優先溶解是開始腐蝕的主要位置,這與本工作結果一致。AlCoCrFeNi2.1 EHEA的fcc相和B2相之間存在局部微電偶,這也是誘發局部腐蝕的原因之一。有研究[37]表明,晶粒尺寸會影響金屬的鈍化行為,AlCoCrFeNi2.1 EHEA的晶粒尺寸差異也會導致局部鈍化膜性質的區別,可能引起電偶作用。也有學者[23]認為,富Ni-Al相優先溶解是由于Al和Ni中的鍵合,這導致Al、Ni易與H2SO4溶液中的OH-和SO
圖7

圖7 AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中浸泡25 d的EDS元素面分布
Fig.7 EDS element mappings of AlCoCrFeNi2.1 EHEA after immersion in 0.05 mol/L H2SO4 solution (a) and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution (b) for 25 d
3 分析討論
3.1 AlCoCrFeNi2.1EHEA的鈍化行為
圖8為在0.05 mol/L H2SO4溶液(圖8a1~e1)和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液(圖8a2~e2)中AlCoCrFeNi2.1 EHEA鈍化膜的Al2p、Co2p3/2、Cr2p3/2、Fe2p3/2和Ni2p3/2的XPS結果。從圖8a1和8a2可知,AlCoCrFeNi2.1 EHEA在2種測試溶液中的Al2p均由金屬態Al (Al0,71.8/71.7 eV)峰和Al2O3 (73.8/73.7 eV)峰組成。圖8b1和b2顯示,Co2p3/2可分為5個組分峰,分別是金屬態Co (Co0,777.7/777.8 eV)、CoO (779.9/780 eV)、Co3O4 (781.3 eV)、Co(OH)2 (782.5/782.6 eV)及Co的衛星峰(
圖8

圖8 AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中恒電位0.2 V (vs SCE)極化2 h后的高分辨XPS圖
Fig.8 High resolution XPS spectra of AlCoCrFeNi2.1 EHEA in 0.05 mol/L H2SO4 solution (a1-e1) and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution (a2-e2) after potentiostatic polarization at 0.2 V (vs SCE) for 2 h (%—peak area percentage)
(a1, a2) Al2p (b1, b2) Co2p3/2 (c1, c2) Cr2p3/2 (d1, d2) Fe2p3/2 (e1, e2) Ni2p3/2
AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中形成表面鈍化膜的Al2p、Co2p3/2、Cr2p3/2、Fe2p3/2和Ni2p3/2各組分峰占總強度的分數已標在圖8中。與0.05 mol/L H2SO4溶液相比,合金在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液形成的鈍化膜中Al2O3占比較高,Cr2O3含量偏低,Cr(OH)3含量上升,引起鈍化膜致密性下降,這與M-S曲線測試結果一致;CoO含量下降,Co0含量上升,其他Co存在形式的占比變化不大,但一般認為Co對酸性溶液中形成的鈍化膜貢獻較小;Fe
3.2 AlCoCrFeNi2.1EHEA的局部腐蝕機理
圖9為AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的腐蝕機理示意圖。圖9a1~a3為合金在0.05 mol/L H2SO4溶液中腐蝕前、亞穩態點蝕的形成和選擇性腐蝕形成過程;圖9b1~b3為合金在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中腐蝕前、亞穩態點蝕的形成和穩態點蝕的形成的過程。在0.05 mol/L H2SO4溶液中,H+優先破壞B2相上的鈍化膜,隨著腐蝕的進一步發生,B2相鈍化膜遭到均勻破壞(圖9a1和a2),B2相發生均勻腐蝕(圖9a3)。而在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中,Cl-吸附在B2相上鈍化膜的局部區域并對其產生破壞(圖9b1),形成亞穩態點蝕(圖9b2),最終誘發點蝕的形核與生長(圖9b3)。依據電化學測試與腐蝕微觀形貌觀察,AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中鈍化區變窄,Eb明顯下降并有較大的點蝕傾向;局部腐蝕優先發生在富Ni-Al的B2相,而fcc相并未出現明顯溶解,這主要是B2相的Al含量較高導致疏松的Al2O3在該相上形成的鈍化膜中占比較大,使鈍化膜的致密性及保護性能下降。AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中出現明顯的點蝕,而在0.05 mol/L H2SO4溶液中并未出現這一現象,主要由于Cl-富集于點蝕坑導致坑內金屬與外部金屬形成濃差電偶,而且Cl-阻礙了鈍化膜的再修復導致鈍化膜破損區域與完整鈍化膜區域形成微電偶,最終導致亞穩態點蝕發展為穩態點蝕。
圖9

圖9 AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的局部腐蝕機理示意圖
Fig.9 Schematics of localized corrosion mechanism of AlCoCrFeNi2.1 EHEA in 0.05 mol/L H2SO4 solution (a1-a3) and 0.05 mol/L H2SO4 + 0.02 mol/L NaCl solution (b1-b3)
(a1, b1) before corrosion
(a2, b2) the form of metastable pitting
(a3, b3) selective corrosion (a3) and the form of stable pitting (b3)
4 結論
(1) AlCoCrFeNi2.1 EHEA在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中的腐蝕均包含活化-鈍化-過鈍化過程,少量的Cl-顯著降低AlCoCrFeNi2.1 EHEA的破鈍電位,輕微加速了陰極反應,但對維鈍電流密度與自腐蝕電位影響不大。
(2) 在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中,AlCoCrFeNi2.1 EHEA的鈍化膜均表現p-n型半導體性質,較高的極化電位導致鈍化膜的缺陷濃度降低,少量的Cl-可導致鈍化膜的缺陷濃度升高。
(3) 在0.05 mol/L H2SO4溶液和0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中,AlCoCrFeNi2.1 EHEA的鈍化膜的主要成分為金屬氧化物和氫氧化物;Cl-主要通過改變鈍化膜中Cr2O3和Al2O3含量進而影響鈍化膜的性質。
(4) 在0.05 mol/L H2SO4溶液中,AlCoCrFeNi2.1 EHEA的腐蝕以富Ni-Al的B2相選擇性溶解為主;在0.05 mol/L H2SO4 + 0.02 mol/L NaCl溶液中,AlCoCrFeNi2.1 EHEA的腐蝕表現為點蝕與選擇性溶解,2者均優先發生于富Ni-Al的B2相。
來源:金屬學報






